

Un'esclusiva per i lettori di Apitalia Online
[Condizioni di accesso ai contenuti di Apitalia Online]
| [Indice degli speciali online] |
| Scrivi il tuo commento a questo articolo! |
| 0 commenti disponibili [Scrivi commento] |
| Ricerca | ||||||||
| Nosema e Fitofarmaci | ||||||||
| di Cyril Vidau(1,2), Marie Diogon(1,2), Julie Aufauvre(1,2), Régis Fontbonne(1,2), Bernard Viguès(1,2), Jean-Luc Brunet(3), Catherine Texier(2), David G. Biron(1,2), Nicolas Blot(1,2), Hicham El Alaoui(1,2), Luc P. Belzunces(3), Frédéric Delbac(1,2) | ||||||||
| Lo studio che pubblichiamo conferma che l’interazione tra N. ceranae e insetticidi costituisce un significativo rischio per la salute delle api. L’aumentato della prevalenza (presenza, ndt) del N. ceranae in Europa, in combinazione con la costante pressione tossica che le api devono subire, sembra contribuire allo spopolamento delle famiglie. Ma l’indagine ci dice che c’è tanto altro da sapere. Tutto ciò dimostra proprio che la ricerca in campo apistico non è certo ferma | ||||||||
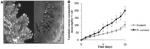 Introduzione IntroduzioneUna significativa, e poco compresa, scomparsa di alveari è riportata da apicoltori e scienziati. Diversi fattori sono stati proposti come elemento di spiegazione della moria delle api, inclusi nutrizione, qualità delle regine, intossicazione da pesticidi e malattie parassitarie. Entriamo nel dettaglio. Apis mellifera (Hymenoptera, Apoidea), può risultare esposta ad un’ampia gamma di pesticidi nel bottinamento o consumando cibo contaminato (polline e miele) stoccati nell’alveare. Gli accusati principali? Due classi di pesticidi sistemici, neonicotinoidi e fenilpirazoli, sono gli imputati numero uno nell’avere effetti negativi sulla salute delle api. E non è certo un caso che vi sia un acceso dibattito in merito al loro impiego: si parla di eventuali restrizioni di questi pesticidi. La ragione? In molti studi, la mancanza di conoscenze, in merito al loro profilo tossicologico, ha impedito di raggiungere solide conclusioni sulla relazione tra esposizione agli insetticidi e moria delle api. Tutto ciò è parzialmente dovuto al fatto che le verifiche di rischio relative ad un pesticida sono principalmente basate sulla valutazione della tossicità acuta, usando la LD 50 (in tossicologia il termine DL 50 è l’acronimo di “Dose Letale 50”, in inglese LD 50 da “Lethal Dose 50”) e si riferisce alla dose di una sostanza, somministrata in una volta sola, in grado di uccidere il 50% (cioè la metà) di una popolazione campione di cavie (generalmente ratti, ma anche altri mammiferi come cani, quando il test riguarda la tossicità nell’uomo). Allo stesso modo viene definito l’LD 90 (in relazione al 90% di una popolazione di cavie, ndr), come valore tossicologico critico. Siamo di fronte, però, ad un approccio contestato perché si afferma che non si tiene conto della tossicità cronica e degli effetti subletali, elementi importanti della tossicità per le api di neonicotinoidi e fenilpirazoli. Un fatto è certo, basse quantità di neonicotinoidi e fenilpirazoli inducono un’ampia gamma di effetti subletali, comportamentali e alterazioni fisiologiche sia in api che in altri artropodi utili. Gli effetti negativi usualmente prodotti da un pesticida sono limitati (nel corpo dell’insetto, ndt) dall’azione di un certo numero di enzimi metabolici. Benché le api abbiano un minor numero di geni deputati alle attività di detossificazione rispetto ad altri insetti, non sono necessariamente più sensibili ai pesticidi. Nelle api i processi di detossificazione, (ovvero l’eliminazione delle sostanze tossiche sia derivanti dall’ambiente esterno che originate dal metabolismo stesso, ndr), avvengono principalmente nello stomaco e nei corpi grassi. Dunque, cambiamenti nell’attività dei sistemi di detossificazione possono portare a variazione di sensibilità ai pesticidi e più generalmente ad alterazioni della loro omeostasi (capacità di un organismo di mantenere costanti le condizioni chimico-fisiche interne anche al variare delle condizioni ambientali esterne fisiologica, ndr). I Parassiti possono a loro volta influire sulla omeostasi dell’insetto e svilupparsi. Ciò, in genere, induce cambiamenti nello sviluppo dell’insetto, nel comportamento, nella riproduzione e nella tolleranza ai parassiti. Cambiamenti fisiologici indotti dal parassitismo (dei patogeni, ndt) possono rendere gli insetti più sensibili agli stress ambientali e possono provocarne una diminuzione del loro benessere. Il concetto è alla base di strategie di lotta integrata che prevedono l’uso di parassiti entomopatogeni (sono entomopatogeni gli organismi che instaurano con l’insetto un rapporto di parassitismo vero e proprio che si manifesta con una patologia a carattere infettivo). L’agente eziologico della patologia è in genere un microrganismo, ma in questa categoria vengono fatti rientrare anche i Nematodi, in quanto i meccanismi e l’eziologia s’identificano più con il parassitismo che con il parassitoidismo, ndr), associati a basse dosi di insetticida. Le api sono anch’esse vittime di questi effetti congiunti. Potenziali interazioni tra Nosema e pesticidi sono state già descritte da Ladas, nel 1972. Più recentemente, Alaux et al., hanno dimostrato che la co-esposizione al microsporidio e a imidacloprid indebolisce l’ape. Il risultato in oggetto fortifica l’ipotesi di cause multifattoriali nelle massicce perdite di api osservate nel mondo. Due specie di microsporidio, Nosema apis e Nosema ceranae, sono agenti delle due maggiori patologie conosciute come nosemiasi A e C. Entrambe le specie sono parassiti intracellulari, obbligati delle api adulte. N. ceranae innalza la domanda energetica dell’ape e diminuisce il livello di zuccheri nell’emolinfa. In aggiunta, l’infezione da N. ceranae sopprime, significativamente, la risposta immunitaria dell’ape e fa crescere la produzione di etil oleato (feromone di tipo primer che regola la maturazione comportamentale delle api domestiche. La sua presenza impedisce loro di divenire bottinatrici, ndt). Da ultimo, le api infette da N. ceranae hanno una vita più corta rispetto alle api non infette. Non ci sono dati relativamente agli effetti di N. ceranae sul sistema di detossificazione delle api. Perciò non è possibile valutare il rapporto tra infezione da N. ceranae e capacità di detossificazione (di pesticidi, ndt) di api infette (da Nosema, ndt) e loro sensibilità ai pesticidi. Comunque, noi ipotizziamo che il sistema di detossificazione possa essere modificato dall’infezione di Nosema dal momento che in massima parte la detossificazione avviene nello stomaco e che questi tessuti sono il sito di proliferazione del N. ceranae. Sempre nello studio abbiamo testato l’impatto del N. ceranae sulle attività di detossificazione dell’ape e la loro sensibilità a fipronil (phenylpyrazole) e thiacloprid (neonicotinoid), due pesticidi rinvenuti in consistenti quantità negli alveari [3]. Le loro LD50, fipronil (LD50, 4.17 µg/ape) e thiacloprid (LD50 17 µg/ape) sono considerate, rispettivamente, altamente e leggermente tossiche per le api. Dimostriamo, comunque, che l’esposizione giornaliera a concentrazioni di 1/100 della LD50 produce un significativo effetto di aumento di mortalità delle api precedentemente infettate da N. ceranae. Discussione Nello studio, poi, si dimostra che dosi subletali di un neonicotinoide (thiacloprid) e di un fenilpirazolo (fipronil) innalzano consistentemente la mortalità di api precedentemente infettate da N. ceranae. Sebbene i meccanismi esatti di questa sinergia rimangano non chiari, i dati suggeriscono che il processo di sensibilizzazione non è fortemente collegato ad una diminuzione della capacità di detossificazione delle api infette da Nosema, o necessariamente ad un aumento della proliferazione di N. ceranae dopo esposizione all’insetticida. Durante il nostro esperimento non è stata osservata mortalità di api a 10 giorni dall’infezione. Numerosi foci erano visibili nelle cellule epiteliali delle api e una media di 18.4.106 (±0.4.106) spore/ape è stata misurata nel tratto digestivo. Così a 10 giorni dall’infezione, possiamo considerare che le api infette del nostro studio mostrano un livello di invasione di N. ceranae simile a quanto osservato nelle bottinatrici da altre ricerche. La prima evidenza di sinergia tra Nosema ed esposizione a insetticidi nelle api è stata prodotta da Alaux et al., 2010. Gli autori hanno dimostrato che il trattamento con Nosema, combinato a esposizione a imidacloprid, un altro neonicotinoide, si evidenzia in un’alta mortalità di api. Basandoci su tali risultati abbiamo ipotizzato che l’infezione da N. ceranae possa alterare il funzionamento del sistema di detossificazione. Abbiamo misurato i sistemi ECOD e GST per valutare la loro attività e poter testare questa ipotesi. Negli insetti, l’attività di ECOD e GST sono spesso servite come misura dell’attività degli enzimi di metabolizzazione. In aggiunta, i livelli di attività di ECOD e GST sono stati associati alla sensibilità agli insetticidi. I risultati mostrano che l’attività di ECOD non subisce variazioni nei 10 giorni successivi all’infezione da Nosema nei corpi grassi e nello stomaco, mentre l’attività di GST aumenta significativamente in entrambi i tessuti. Perciò i dati indicano che l’alta mortalità osservata dopo l’esposizione all’insetticida delle api, precedentemente infettate da N. ceranae, non è fortemente collegata a diminuzione delle capacità di detossificazione. Tuttavia, non possiamo escludere che l’infezione da N. ceranae possa modificare la produzione di altri enzimi coinvolti nella detossificazione di questi insetticidi. L’esposizione a dosi subletali di fipronil e thiacloprid aumenta la mortalità di api infettate da N. ceranae. Si consideri che nella nostra procedura sperimentale, a 10 giorni dall’infezione, le api sono state esposte in maniera cronica a quantità molto basse di insetticida, per 10 giorni. Il consumo di Fipronil non è risultato differente fra api infette e non infette, con una media corrispondente ad una esposizione equivalente alla LD50/158 (25.3 ± 4.8 pg/ape), per le api non infette e LD50/148 (26.9 ± 0.8 pg/ape), per api infette. Una simile esposizione è stata considerata subletale da Aliouane et al. Alla stessa maniera le api esposte a thiacloprid hanno consumato una quantità giornaliera similare equivalente alla LD50/151 (112.1 ± 4.4 ng/bee) per non infette e LD50/112 (152.8 ± 8.7 ng/bee) per infette. Come supposto, questi livelli di esposizione di fipronil e thiaclopri non hanno nessun effetto sulla mortalità delle api non infette da Nosema e neppure sul loro comportamento. Gli stessi livelli di esposizione di api infette da Nosema causano sintomi di avvelenamento e aumentano la mortalità. Non essendo riusciti a spiegare il fenomeno sulla base del metabolismo di detossificazione, siamo passati a studiare l’effetto dell’esposizione agli insetticidi sulla produzione di spore. I risultati indicano che l’esposizione a fipronil ha un effetto antagonista sulla produzione di spore. Infatti, in comparazione con api infettate non esposte all’insetticida, la produzione di spore diminuisce del 33% durante l’esposizione a fipronil. Invece, la produzione di spore cresce del 40% con esposizione a thiacloprid. I risultati non spiegano la crescita di mortalità osservato in presenza di insetticidi. Alcune considerazioni sono d’obbligo. Innanzitutto, l’esposizione a fipronil e thiacloprid induce un aumento di mortalità nelle api infette da Nosema, ma ha un effetto opposto sulla produzione di spore di Nosema. Poi, nel caso di thiacloprid, la maggior produzione di spore non sembra sufficiente a spiegare l’aumento di mortalità di api. L’effetto di interazione osservato tra N. ceranae e insetticidi sulla mortalità di api è in sintonia con le osservazioni in api infette da Nosema sp. e esposte a imidacloprid. Tuttavia, mentre l’effetto sinergico, descritto da Alaux et al., sembra collegato ad un aumento di consumo di imidacloprid da parte delle api infette da Nosema, l’effetto sinergico osservato nel nostro studio, comunque, non è dovuto ad un aumento della quantità di alimentazione assunta dopo l’infezione. I nuovi dati sull’azione sinergica di Nosema e insetticidi mettono in luce che questo tipo di interazioni (fitofarmaco-patogeno, ndt) non sono ristrette ai neonicotinoidi (imidacloprid, thiacloprid), ma estese ad altre classi di insetticidi, inclusi fenilpirazoli. Un’ulteriore generalizzazione del fenomeno, in api esposte ad altri insetticidi, non sarebbe sorprendente. Alcune categorie di insetticidi chimici hanno già mostrato adeguato potenziale per interagire in maniera sinergica con funghi entomopatogenici in altre specie di insetti. Questi tipi di combinazioni sono, comunemente, usate in lotta integrata perché vi è un effetto di contrasto alla formazione di resistenze agli insetticidi in molti insetti ed è in questo modo possibile la riduzione della dose di insetticida immesso nell’ambiente. Ad esempio, composti organofosforici (oxydemeton methyl) e piretrinoïdi (permethrin), usati in combinazione con Beauvaria bassiana, inducono un maggiore impatto su Spilarctia obliqua e Anopheles gambiae, rispetto a quanto prodotto dal solo agente di controllo. In generale, l’effetto sinergico di queste combinazioni appare a dosi di insetticida considerate subletali per l’insetto (bersaglio). Nel nostro studio, il maggior effetto osservato con tali combinazioni include un aumento della tossicità dell’insetticida (diminuzione di LD50 o LC50) e una diminuzione del tempo necessario a produrre la morte dell’insetto (ape). Ciò suggerisce che la suscettibilità degli insetti ai pesticidi sia un fenomeno più complesso di quanto fino ad ora pensato. L’influenza di parassitismo nell’ecosistema deve esser presa in considerazione negli studi tossicologici. Come mostrato nel nostro studio, l’uso della LD50, come indicatore della tossicità di insetticida sistemico, porta ad una sottostima degli effetti deleteri indotti in api infette (da Nosema ceranae). Certamente, abbiamo dimostrato che dosi subletali di insetticida hanno un alto impatto sulla mortalità di api infette da Nosema. La precauzione è importante dal momento che N. ceranae si diffonde rapidamente e può colpire più del 80% delle famiglie di api. Numerosi esempi di interazione tra prodotti chimici e patogeni che affliggono gli insetti sono stati descritti. Sfortunatamente, i meccanismi fisiologici coinvolti in queste interazioni permangono scarsamente compresi e possono apparire contraddittori. Una delle correnti ipotesi suggerisce che metaboliti del patogeno possano interferire coi processi di detossificazione. Una diversa assegnazione degli enzimi di detossificazione degli insettici, una parte dei quali è utilizzato per contrastare lo sviluppo del patogeno, potrebbe ridurre la quantità di enzimi disponibili per la neutralizzazione dell’insetticida col risultato di un cambiamento della tossicocinetica. Pertanto, è possibile che gli effetti sinergici risultino in un effettivo aumento della sensibilità agli insetticidi in presenza di infezione di un parassita proliferante. Ironicamente, i pochi dati pubblicati, relativamente agli effetti di parassitismo sugli enzimi di metabolizzazione degli insetti, mostrano che un largo insieme di infezioni parassitarie possono attivare diverse proteine implicate nella detossificazione (esempi- CYP’s, GST, esterasi). In maniera consistente dimostriamo, nel nostro studio, che 10 giorni dopo l’infezione da N. ceranae, l’attività di GST aumenta sia nello stomaco che nei corpi grassi dell’ape, in accordo con l’aumento di attività antiossidante, recentemente descritta in regine infette da Nosema. Il risultato contrasta con l’aumento di suscettibilità agli insetticidi delle api infette da Nosema, suggerendo che GST possa non essere coinvolto nei processi di detossificazione di fipronil e thiacloprid. Comunque, la produzione di monoossigenasi microsomale è un processo inducibile e rimane possibile che induzione di detossificazione in risposta a esposizione a insetticidi sia impedita dall’infezione da Nosema. Di modo che le api non infette sono in grado di rispondere agli insetticidi, aumentando i processi di detossificazione, mentre le api infette da Nosema non possono. Ciò potrebbe spiegare i sintomi di intossicazione osservati nelle api infette. Curiosamente, in molti studi sugli effetti sinergici di funghi e insetticidi l’impatto dell’esposizione agli insetticidi sulla virulenza del parassita non è investigata. Nei rari studi che considerano tale aspetto, la virulenza del parassita non è aumentata dal parassita. Di contro, malgrado l’effetto sinergico sulla mortalità di insetti, risulta che l’esposizione agli insetticidi tende a diminuire germinazione o proliferazione del fungo. Sicuramente, gli insetticidi hanno il potenziale per agire sui vari stadi di sviluppo dei funghi entomopatogeni e giustificare perché studi di compatibilità tra parassiti e insetticidi sono importanti per lo sviluppo di strategie di lotta integrata. Nel nostro studio, fipronil e thiacloprid hanno effetto antagonista sulla proliferazione di N. ceranae, con fipronil che diminuisce leggermente la produzione di spore nello stomaco dell’ape. L’effetto può essere attributo sia all’effetto citotossico del fipronil sull’epitelio intestinale che alla sua azione pro-ossidante che può influire sul ciclo di riproduzione di N. ceranae. Tali asserzioni, però, devono essere confermate con altri esperimenti. Di contro, thiacloprid aumenta la produzione di spore. Il risultato non è concorde con le osservazioni di Alaux et al.: si mostra che imidacloprid diminuisce leggermente la produzione di spore nello stomaco dell’ape. Così, nel nostro studio l’effetto sinergico dell’infezione da N. ceranae e l’esposizione all’insetticida non appare correlata ad aumento di virulenza del N. ceranae, in conseguenza della presenza di insetticidi. Per concludere, i nostri lavori confermano che l’interazione tra N. ceranae e insetticidi costituisce un significativo rischio per la salute delle api. L’aumentare della prevalenza (presenza, ndt) del N. ceranae in Europa, in combinazione con la costante pressione tossica che le api devono subire, sembra contribuire allo spopolamento delle famiglie. Una miglior comprensione degli effetti fisiologici indotti da basse quantità di pesticidi e infezione da Nosema sembra essenziale per chiarire l’effetto sinergico osservato relativamente alla mortalità di api. La scoperta di molecole e meccanismi cellulari coinvolti in questi effetti avversi indotti da patogeno e pesticidi potrebbe confermare l’influenza di questi elementi di stress sulla salute delle api. In aggiunta, i dati trovati offrono informazioni aggiuntive che consentono una migliore valutazione dei rischi associati a tali elementi stressanti, mettendo in luce l’urgente necessità di medicinali veterinari per il trattamento del Nosema. |
||||||||
|
Titolo originale del lavoro
“Exposure to Sublethal Doses of Fipronil and Thiacloprid Highly Increases Mortality of Honeybees Previously Infected by Nosema ceranae” La Bibliografia e il lavoro sono disponibili sul sito: http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0021550 |
||||||||
| IMMAGINI ALLEGATE A QUESTO ARTICOLO: 4 tot. | ||||||||
|
||||||||
| Scrivi il tuo commento a questo articolo! |
| 0 commenti disponibili [Scrivi commento] |
 © Apitalia - Tutti i diritti riservati © Apitalia - Tutti i diritti riservatiScritto in data 14/11/2011 da Cyril Vidau(1,2), Marie Diogon(1,2), Julie Aufauvre(1,2), Régis Fontbonne(1,2), Bernard Viguès(1,2), Jean-Luc Brunet(3), Catherine Texier(2), David G. Biron(1,2), Nicolas Blot(1,2), Hicham El Alaoui(1,2), Luc P. Belzunces(3), Frédéric Delbac(1,2) (1) Università di Clermont, Università “Blaise Pascal”, Laboratoire Microorganismes: Génome et Environnement, Clermont-Ferrand, Francia (2) CNRS, UMR (Centro Nazionale di Ricerca Scientifica), Aubière, Francia (3) INRA (Istituto Nazionale di Ricerca Agronomica), Abeilles & Environnement, Laboratoire de Toxicologie Environnementale, Avignone, Francia |
| COMMENTI A QUESTO ARTICOLO: 0 tot. |
|
|
| [Torna ad inizio pagina] |







