Un'esclusiva per i lettori di Apitalia Online
[Condizioni di accesso ai contenuti di Apitalia Online]
| [Indice degli speciali online] |
| Scrivi il tuo commento a questo articolo! |
| 0 commenti disponibili [Scrivi commento] |
| Biologia | ||||
| Il bilancio proteico delle api operaie | ||||
| di K. Crailsheim | ||||
| Nelle api operaie, il fabbisogno e consumo proteico, la digestione, l’assorbimento intestinale e l’utilizzo delle proteine, sono tutti fattori che dipendono dall’età dell’ape e dal suo status funzionale nel sistema di ripartizione del lavoro all’interno della colonia. Le operaie che rientrano nella sotto casta delle nutrici giocano un ruolo fondamentale non solo nella digestione delle proteine ma anche nella loro distribuzione. Le nutrici sono ben attrezzate per la digestione di polline, sono ricche di proteine all’interno del proprio organismo e sono capaci di produrre grandi quantità di gelatina, che viene poi distribuita a quasi tutti i membri della colonia | ||||
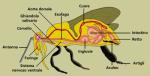
 INTRODUZIONE INTRODUZIONEL'ape è uno dei pochi insetti la cui importanza commerciale ne determina l’allevamento da parte dell’uomo e non il suo contrasto. Ciò ha comportato la produzione di numerose ricerche relative ai suoi comportamenti nutrizionali. Molte pubblicazioni hanno interessato il tipo di alimentazione delle colonie, l'influenza della nutrizione artificiale sulle stesse o la funzione dei prodotti alimentari derivati dalle api. Tuttavia, molte domande relative al metabolismo delle proteine rimangono senza risposta, a causa della complessità e plasticità del sistema sociale delle api. Il polietismo temporale delle caste delle operaie dipende principalmente dall’età dell’insetto, ma la divisione del lavoro è anche influenzata dalla disponibilità di cibo all’interno ed all’esterno dell'alveare, nonché dalle esigenze reali della colonia (Rösch, 1925, 1930; Lindauer, 1952; Ribbands 1952; Free, 1965; Michener, 1969; Seeley, 1982; Winston e Neilson Punnet, 1982; Kolmes, 1985) e dalla stagione (Merz et al, 1979). I livelli ormonali [ci si riferisce alla presenza di ormone giovanile nell’ape adulta N.d.T.] influenzano l’inizio di una diversa età, intesa come fase dipendente e connaturata a specifiche mansioni (Robinson, 1987; Robinson et al., 1989). Negli ultimi anni sono stati studiati sempre di più dal punto di vista genetico i fattori che controllano e determinano questi meccanismi (Calderone e Page, 1988; Frumhoff e Baker, 1988; Robinson e Page,1988; Kolmes et al., 1989; Robinson et al., 1989; Rothenbuler Page, 1989). Questo articolo descrive il metabolismo delle proteine nelle api operaie, con particolare attenzione verso l’età e funzione delle stesse. NUTRIENTI PROTEICI Subito dopo la schiusa dell’uovo, le larve di operaia vengono rifornite di gelatina prodotta dalle ghiandole ipofaringee delle nutrici (Hanser e Rembold, 1964; Rembold, 1974) fino a raggiungere un’età di 3,5 giorni. Successivamente, esse ricevono una miscela di gelatina, miele e polline; e questo secondo tipo di alimento è una miscela di cibo caratterizzata da un apporto inferiore di proteine ma da più carboidrati (von Rhein, 1956; Kunert e Crailsheim, 1987). Circa 1/3 del peso netto della gelatina consiste di proteine ad elevato peso molecolare (Habowsky e Shuel, 1959; Patel et al., 1960). La percentuale di proteine presenti nel cibo destinato alle giovani larve dipende non solo dall’età delle larve ma è anche soggetta a fluttuazioni stagionali: durante l’estate si verifica un calo che può variare da oltre il 50 % (peso netto di proteina) a meno del 30%, così come dimostrato in due colonie studiate parallelamente (Kunert e Crailsheim, 1987). Subito dopo lo sfarfallamento, le giovani api iniziano a consumare miele e pane d’api nei pressi della zona vicina alle celle originarie di covata (Lotmar,1938; Lindauer, 1952; Dietz, 1969; Haydak, 1970; Hagedorn e Moeller, 1967). Il “pane d’api” è il polline che è stato precedentemente raccolto dalle bottinatrici e successivamente stoccato nei favi. Questo polline è mescolato a secrezioni emesse dalle bottinatrici (Pain e Maugenet, 1966; Maurizio, 1969; Herbert e Shimanuki, 1978) e contiene vari microorganismi (Pain e Maugenet, 1966; Gilliam et al., 1989). Il valore nutrizionale del polline stoccato in questo modo è superiore a quella del polline stoccato in laboratorio (Beutler et al., 1949; Van Der Vorst e Jacobs, 1980). Inoltre, la nuova generazione di operaie appena sfarfallate riceve altro cibo attraverso la trofallassi e dunque l’apporto di api più anziane. Perepelova (1928) ha osservato che le api di 1-3 giorni di età vengono nutrite da altre consorelle la cui età varia dai 7 ai 14 giorni. Free (1957, 1959) ha rilevato inoltre che le giovani api ricevono cibo da altre api di differente età, e tuttavia ha anche confermato che le nutrici di età compresa tra i 7-14 giorni sono predominanti nel gruppo che rifornisce di cibo le giovani operaie. A partire da circa il terzo giorno di vita, il numero delle interazioni tra api nel dare e ricevere cibo (trofallassi) sono numericamente simili, ma generalmente si rileva un maggiore trasferimento di cibo dalle vecchie alle giovani api che non nella direzione opposta (Free, 1957). Mentre la sottocasta di età compresa tra i 7-14 giorni rifornisce di proteine le larve, si potrebbe dedurre dalle risultanze di cui sopra che le giovani api appena sfarfallate ricevano non solo miele ma anche miscele ricche di proteine derivate dalle ghiandole ipofaringee delle nutrici. Questi scambi noti come trofallassi si verificano anche quando le api sono in gabbia (Free, 1957; Korst e Velthuis, 1982; Moritz e Hallmen, 1986). Tali esperimenti di laboratorio sono stati utilizzati per verificare il trasferimento di alimento proteico tra le nutrici e le api di un giorno d’età (Crailsheim, 1990). Questo trasferimento è stato dimostrato anche in colonie allevate sul campo (Crailsheim, 1990). Il polline è la principale fonte naturale di proteine per le api. Il nettare raccolto dalle bottinatrici contiene invece basse concentrazioni di amminoacidi (Baker e Baker, 1973). La quantità di polline consumato dalle operaie aumenta fino a quando le api raggiungono l’età/funzione di nutrici (Lotmar, 1938; Lindauer, 1952; Pain, 1961), dopodiché il consumo di polline tende a diminuire. Durante l’inverno, quando non c’è cibo disponibile al di fuori dell’alveare, le api consumano il cibo conservato nell’alveare, vale a dire miele e pane d’api (per quel poco che c’è N.d.T.). Il pane d’api è di fondamentale importanza sia per la sopravvivenza invernale della colonia sia per l’inizio del suo ripopolamento in primavera (Wille et al., 1987). Un modo differente per ottenere delle proteine è costituito dal cannibalismo. In alcune situazioni, come la mancanza di cibo proteico, le operaie possono trovarsi costrette a mangiare uova e covata (Haydak, 1935; Myser, 1952; Newton e Michl, 1974). Il nutrimento derivato dal cannibalismo può allungare l’aspettativa di vita delle api che vi si dedicano (Weiss, 1984), oppure può essere utilizzato per allevamento della covata o l’alimentazione della regina (Weiss, 1984; Webster e Peng, 1987; Webster et al., 1987). QUALITA' DELLE PROTEINE Che il polline sia un alimento necessario per una colonia d’api è un dato noto da tempo (Eckert, 1942). Due autori hanno stabilito nei primi anni Cinquanta del ‘900 i fondamenti essenziali per tutte le successive ricerche relative al metabolismo ed alle qualità delle proteine. Maurizio (1954) ha descritto l’importanza del polline per le colonie e Groot (1953) ha descritto il valore nutrizionale delle varie fonti proteiche rispetto alle colonie nonché il fabbisogno delle singole api. Groot ha classificato i seguenti 10 amminoacidi come essenziali per la sviluppo delle api: arginina, istidina, lisina, triptofano, fenilalanina, metionina, treonina, leucina, isoleucina e valina. I maggiori fabbisogni erano relativi a leucina, isoleucina e valina. Pertanto, il valore nutrizionale del polline per le api è definito soprattutto rispetto al suo contenuto assoluto e relativo di amminoacidi essenziali. Di conseguenza, il polline derivato da piante differenti avrà un valore nutrizionale differente per le api. Questo dato è dimostrato dalla misurazione di diversi parametri come la crescita e lo sviluppo dei corpi grassi (Maurizio,1954), lo sviluppo delle ghiandole ipofaringee (Maurizio, 1954; Standifer, 1967), l’aspettativa di vita (Maurizio, 1954; Wahl, 1963 ; Schmidt et al, 1987) o l’allevamento della covata (Wahl, 1963, Herbert et al, 1970). Api in cattività mostrano la capacità di distinguere tra diversi tipi di polline. Preferiscono polline ricco di proteine (Schmidt e Johnson, 1984) e reagiscono alla presenza di sostanze fagostimolanti (che inducono cioè l’insetto alla nutrizione N.d.T.) presenti nel polline (Schmidt, 1985). Per le api in natura alle quali viene fornita nutrizione artificiale risulta di minore importanza sia l’età del polline (Dietz e Haydak, 1965; Hagedorn, 1968) che il modo in cui viene raccolto, ovvero che il polline sia stato raccolto da esseri umani o dalle api (Maurizio, 1954), questo non influenza il suo valore per le api. TRASPORTO INTESTINALE, DIGESTIONE E ASSORBIMENTO Il polline viene ingerito dalle api sia fresco che sotto forma di pane d’api. Non avviene una digestione del polline raccolto, in quanto le ghiandole salivali ed ipofaringee non producono enzimi proteolitici (Arnold e Delag-Darchen, 1978). Gli amminoacidi presenti nel nettare non oltrepassano la parete della parte superiore dello stomaco detta ingluvie o borsa melaria (crop) (Crailsheim, 1988). I granuli di polline sono rapidamente trasportati attraverso la porzione del proventricolo che regola il passaggio di tutti i nutrienti nell’intestino di mezzo (midgut). In relazione con il consumo più massiccio di polline, la casta delle operaie possiede un proventricolo più grande rispetto ai fuchi ed alla regina (Pabst e Crailsheim, 1990). Il trasporto di liquidi è regolato a seconda delle esigenze (Crailsheim,1988); mentre il cibo solido, ossia il polline, è compresso dal proventricolo in pallottoline (bolusses) che vengono poi trasportate attraverso una valvola, un tubo flessibile (Trappman, 1923) nello stomaco medio (midgut) (Whitcomb e Wilson, 1929; Bailey, 1952; Schreiner, 1952; Barker e Lehner, 1972; Klungness e Peng , 1984; Peng e Marston, 1986). Lì, le palline di polline sono circondate dalla membrana peritrofica e non lasciano il tubulo della membrana peritrofica (spazio endoperitrofico), ma passano attraverso l’intestino anteriore nel retto (Schreiner, 1952). Il tempo necessario per il passaggio attraverso l’intestino medio dipende dalla quantità dei prodotti alimentari in questa sezione, dall’età delle api e dalla loro condizione generale; la lunghezza del periodo di tempo dall'ingestione del polline fino alla sua espulsione attraverso il retto può variare da poche ore fino a più di un giorno. Un maggior lasso di tempo può rendersi necessario perché il polline è difficile da digerire a causa della sua particolare consistenza (Barker e Lehner, 1972; Klungness e Peng, 1984; Peng et al., 1986). Alcuni tipi di polline lasciano il tratto intestinale senza essere completamente metabolizzati (Peng et al., 1985). Per una miscela di pollini differenti, appositamente forniti alle api, è stata dimostrata da Schmidt e Buchmann (1985) una digeribilità apparente del 77%. La membrana peritrofica forma nelle api compartimenti finalizzati alla digestione (Moritz e Crailsheim, 1987), così come anche descritto per altri insetti (Terra et al., 1979; Terra e Ferreira, 1981; Terra 1988, 1990) e contengono aminopeptidasi immobilizzati (Peters e Kalnins, 1985). La composizione chimica delle membrane dipende dall’età delle api (Pabst et al., 1988). Entrando nell’intestino, il polline è assimilato o attraverso uno shock osmotico (Kroon et al., 1974) e/o dagli effettidi enzimi proteolitici. In un’altra specie d’ape (la Melipona quadrifasciata), lo shock osmotico è meno pronunciato e causato solo d’apertura dei pori del polline di cereali (Martinho, 1975). Gli enzimi proteolitici sono presenti in misura limitata nell'ultimo stadio di sviluppo delle pupe e nelle giovani api dopo lo sfarfallamento, ma aumentano rapidamente nelle prime ore di vita immaginale (Moritz e Crailsheim, 1987). Pavlovsky e Zarin (1922) furono i primi a studiare estesamente gli enzimi proteolitici presenti nell’intestino delle api da miele, e ne hanno individuato diversi tipi. Giebel et al (1971) hanno descritto 4 endopeptidasi con proprietà diverse. Dahlman et al. (1978) hanno individuato solo 3 endopeptidasi, 1 trypsinelike e 2 chymotrypsine-like. Grogan e Hunt (1980, 1984) hanno invece dimostrato anzitutto le differenze dell’attività proteolitica dell’intestino tra le api di casa (coloro che non provvedono ancora al foraggiamento della famiglia) e le bottinatrici; Moritz e Crailsheim (1987) hanno dimostrato una stretta correlazione ed una dipendenza dell’età delle api con il contenuto proteico assimilabile nell’intestino. Gli enzimi Tripsina-like e chymoptrypsinelike hanno mostrato la loro massima attività rispettivamente a pH 8,5 e pH 8. I più alti livelli di attività proteolitica sono stati riscontrati nelle api nutrici; e questa attività è diminuita quando le api hanno cominciato a bottinare. Bassi livelli sono stati riscontrati nelle api invernali, e la stessa popolazione di api ha mostrato un lieve aumento dei livelli di attività proteolitica quando le api hanno cominciato di nuovo a bottinare e conseguentemente nutrire la covata in primavera. L’attività proteolitica nell’intestino delle operaie è anche influenzata dalla esigenze del sistema sociale del super-organismo alveare. Né la presenza della regina né la presenza di covata aperta si sono rivelate condizioni necessarie per il normale sviluppo dell’attività intestinale proteolitica in api poste all’interno di una colonia, ma i livelli proteolitici si sono dimostrati molto più bassi in api poste in gabbie, benché inserite in gruppi e con sufficiente cibo proteico. Risulta influenzare i livelli proteolitici anche la composizione della dieta (Crailsheim e Stolberg, 1989). Scarsa attività proteolitica è stata rinvenuta nel tessuto intestinale, un po’ di più nell’area ectoperitrofica e in quella endoperitrofica in cui il polline viene trasportato (Moritz e Crailsheim, 1987; Jimenez e Gilliam, 1989). Questi ultimi ricercatori postulano un flusso controcorrente nell’ambito endo e ectoperitrofico come descritto per altri insetti (Terra e Ferreira, 1981; Terra et al., 1985; Terra, 1988, 1990). Tale flusso consente di utilizzare in modo ottimale gli enzimi e spiega perché solo piccole quantità di liquido transitano dall’intestino al retto delle api (Crailsheim,1988). Per le api, rispetto ad altri insetti, si dispone di un minor numero di informazioni relative all’assorbimento di sostanze attraverso le pareti intestinali (Turunen, 1985). Il trasporto degli zuccheri ha dimostrato di essere passivo per semplice diffusione (Crailsheim, 1988). Studi successivi hanno dimostrato che la concentrazione dipende dal trasporto di leucina, così come da quello di amminoacidi strutturalmente simili come isoleucina, ma non da glicina, arginina o acido glutammico (Crailsheim, 1988). Questa scoperta di un meccanismo piuttosto specifico di trasporto potrebbe essere confermata da esperimenti in vitro che inoltre dimostrano che il trasporto di leucina non dipende dalla disponibilità di energia (Haszonits e Crailsheim, 1990). Ricerche in vivo - così come esperimenti in vitro avevano in precedenza mostrato diverse capacità di trasporto metabolico delle api in estate che in inverno - hanno rivelato una maggiore velocità metabolica di trasporto in estate. Questi risultati sono in accordo con i dati relativi al metabolismo delle proteine. Studi morfologici offrono una spiegazione per la capacità di trasporto inferiore degli amminoacidi in inverno. Gli studi di Freezetch mostrano un minor numero di particelle nella membrana plasmatica delle cellule del tratto epiteliale delle api invernali (Pabst e Crailsheim, 1987); tali particelle sono descritte nei mammiferi come vettori di enzimi. UTILIZZO DELLE PROTEINE Elevate quantità di proteine sono necessarie allo sviluppo di una larva; lo sviluppo larvale di una singola larva comporta circa 50 mg gelatina per raggiungere un peso di 35 mg (von Rhein, 1956). Nel corso di circa 3,5 giorni di vita, l’elevato contenuto proteico di una larva di 3 mg varia da quasi il 19% (di peso netto) a circa il 9 % (Kunert e Crailsheim, 1987). Per tale ragione, se le nutrici non ricevono cibo proteico, possono continuare a svolgere la propria funzione, ma solo per circa 1 settimana. Tutte le larve alimentate oltre questo periodo sono risultate incapaci di raggiungere la maturità e sono stati rimosse dalle api. Le nutrici private di proteine avevano livelli più bassi di nitrogeno in tutte e tre le sezioni del corpo rispetto a nutrici precedenti la privazione di apporto proteico. La maggiore riduzione (-11 %) è stata riscontrata nell’addome. Haydak (1935) conclude da questi risultati che le nutrici usano le proteine stoccate nei propri tessuti per l'allevamento delle larve. Le larve che sono state allevate con questi deficit nutrizionali raggiungono la maturità, ma risultano sottosviluppate (Jay, 1964). Dopo lo sfarfallamento, le api richiedono proteine per la differenziazione del tessuto immaginale. Esse consumano una grande quantità di polline e ricevono cibo proteico dalle altre operaie. Dopo lo sfarfallamento, presentano un contenuto di nitrogeno pari a 1,74 mg; questo aumenta fino a 2,65 mg in api di 21-38 giorni di età (Haydak, 1934). La comparazione dei dati relativi ai livelli di proteine con i livelli di nitrogeno nelle operaie emersi dalle differenti ricerche si deve a Kunert e Crailsheim (1988). Il contenuto di proteine rilevato dipende dalla disponibilità di cibo al di fuori dell'alveare durante il periodo di allevamento della covata; la differenza tra api allevate in un periodo negativo in termini di raccolta di polline e api allevate in buone condizioni di importazione di proteine, è oltre il 13%. Nella fase critica, le api che erano destinate a trascorrere l’inverno avevano un contenuto proteico superiore alle api dell’estate (Kunert e Crailsheim, 1988). Queste api invernali sono state allevate durante la tarda estate e in autunno, un periodo caratterizzato da meno disponibilità di polline all’esterno dell’alveare, ma con notevole quantità di pane d’api all’interno. Inoltre, molto meno larve vengono allevate in quel periodo rispetto al periodo compreso tra maggio e luglio. Durante il periodo di confino nell’alveare, il più notevole incremento di proteine si è riscontrato nelle teste, e le nutrici avevano circa il doppio di quantità presente nelle api appena sfarfallate (Haydak, 1934). Ciò è dovuto al sistema di ripartizione del lavoro all’interno del super-organismo alveare. Le operaie in età da nutrici hanno ghiandole ipofaringee ben sviluppate (Krathky, 1931; Moskovljevic-Filipovic, 1952; Groot, 1953; Maurizio, 1954; Beams et al, 1959; Fluri et al, 1982; Moritz e Crailsheim, 1987; Fergusson e Winston, 1988; Suzuki, 1988; Crailsheim e Stolberg, 1989; Knecht e Kaatz, 1990) che sono superbamente attrezzate per la sintesi di secrezioni ricchissime in termini proteici (Brouwers, 1982; Takenaka e Kaatz, 1987; Webster et al., 1987; Webster e Peng, 1987; Knecht e Kaatz, 1990; Crailsheim, 1990). Le secrezioni di queste ghiandole sono poi distribuite in tutta la colonia. Lo sviluppo di queste ghiandole è stimolato da un segnale (feromonale) della covata (Huang e Otis, 1989; Huang et al., 1989) e inibito dall’espressione di ormone giovanile (Jaycox et al., 1974; Fluri et al., 1982; Liu, 1989), almeno in presenza di elevati dosaggi (Sasagawa et al., 1989). Le operaie con le maggiori capacità di sintesi proteica presentano elevate quantità di proteine nell’emolinfa (4,3%), mentre questo tasso scende nelle bottinatrici al 1,7% (Sinizki e Lewtschenko, 1971). In inverno, i livelli di proteine sono ancora più elevati che in estate e ciò è dovuto ad un’espressione inferiore dell'ormone giovanile (Fluri et al., 1982). In estate, quando le operaie smettono di produrre gelatina al raggiungimento dell’età di bottinatrici, le ghiandole ipofaringee atrofizzate producono altre sostanze, principalmente enzimi (Simpson et al., 1968; Halberstadt, 1980; Sasagawa et al., 1989). Il corretto sviluppo delle ghiandole ipofaringee dipende da una corretta alimentazione (Soudek, 1927, Free, 1961; Maurizio, 1962; Standifer, 1967; Herbert et al., 1977) e dall’esistenza di un sistema sociale - e quindi da una divisione del lavoro per età nell’alveare N.d.T. - (Crailsheim e Stolberg, 1989). Schmidt e Buchmann (1985) fornendo all’interno della normale dieta il corretto apporto pollinico ad una piccola famiglia d’api, hanno determinato una necessità media di 3,07 mg di nitrogeno per ogni ape della colonia per 28 giorni. Ciò corrisponde a 19,2 mg di proteine. I corpi grassi sono l’organo deputato allo stoccaggio di proteine nelle larve d’ape e contengono elevate quantità proteiche. La composizione di questi organi varia con l’età (Krajewska e Hryniewiecka-Szyfter, 1988). Successivamente, essi forniscono il materiale per lo sviluppo dei tessuti delle pupe nello stadio immaginale (Schnelle, 1923). Dopo lo sfarfallamento, il contenuto proteico dei corpi grassi aumenta fino a quando l’operaia raggiunge l’età/funzione di nutrice in estate. Il contenuto proteico è quindi più basso nelle bottinatrici e più alto invece nelle api invernali (Shehata et al, 1981; Fluri e Bogdanov, 1987; Southwick, 1989). Le api invernali hanno un maggiore livello di proteine nell’emolinfa e più proteine nelle loro ghiandole ipofaringee rispetto alle bottinatrici in estate (Fluri et al, 1982). Così, le ghiandole ipofaringee, insieme ai corpi grassi , funzionano come “magazzini” per lo stoccaggio delle proteine. Molte proteine circolanti nell’emolinfa sono prodotte dai corpi grassi (Lensky eRakover, 1983). Iniezioni di amminoacidi marcati radioattivamente e somministrazione di proteine marcate allo stesso modo consentono di determinare i luoghi del metabolismo ed i livelli di proteine coinvolte. Un’elevata attività delle ghiandole ipofaringee è stata dimostrata con metodi traccianti (Webster e Peng, 1987; Webster et al., 1987; Knecht e Kaatz, 1990; Crailsheim, 1990). Novanta minuti dopo un’iniezione di C1 - phenyla4lanine, le nutrici avevano più del 25 % della radioattività nella frazione proteica del capo (la testa è sede delle ghiandole ipofaringee N.d.T.) meno del 10 % nel torace e più del 25% nell’addome. Le bottinatrici hanno mostrato risultati simili relativamente al torace ed all’addome, ma un tasso leggermente inferiore al 10% nella testa. Più della metà del sostanza tracciante è stata rinvenuta nel capo delle nutrici, e quindi nelle ghiandole ipofaringee, dopo 6 ore (Crailsheim, 1990). I livelli più alti della quantità totale di proteine si sono rilevati per un periodo più breve nelle bottinatrici (11-13 giorni), mentre nelle nutrici erano circa il 50% in più e 4 volte in più nelle api invernali (Crailsheim, 1986). La riduzione del metabolismo nelle api invernali (Omholt e Lonvik, 1986) è un adattamento utile alla diminuzione delle funzioni vitali di queste api. Molte di loro rimangono quasi immobili durante i periodi trascorsi al di fuori del glomere e quindi non dovrebbe essere necessario molto turnover proteico. Al contrario, le nutrici che in estate debbono svolgere il compito di “organo digerente” per la gran parte della colonia hanno invece bisogno di molte proteine, che consumano velocemente. Le loro strutture enzimatiche sono adatte a questo lavoro metabolico. Le bottinatrici sono altamente attive e coprono, in media, 21,5 km al giorno (Neukrich, 1982) che richiede un equivalente metabolico superiore a 6 mg zucchero esclusivamente dedicato al volo (Heran e Crailsheim, 1988); tale quantità di lavoro metabolico è certamente destinato ad aumentare il turnover proteico. Pertanto, esse sono in grado probabilmente di assorbire più leucina e altri amminoacidi rispetto alle api invernali (vedi paragrafo precedente). Le api da miele sono note per l’utilizzo di carboidrati per il loro fabbisogno energetico durante il volo (Nachtigall et al., 1989). Tuttavia, una frazione considerevole di Carbonio da Carbonio amminoacido ha dimostrato di essere espulsa sotto forma di CO2 (anidride carbonica) (Webster et al., 1987; Crailsheim,1988, 1990) in api che stavano riposando o camminando, dimostrando che gli amminoacidi sono in ultima analisi ripartiti e utilizzati per l'energia necessaria al metabolismo. Quest’ultima funzione richiede ulteriori indagini rispetto alle condizioni derivate dal volo. |
||||
| IMMAGINI ALLEGATE A QUESTO ARTICOLO: 2 tot. | ||||
|
||||
| Scrivi il tuo commento a questo articolo! |
| 0 commenti disponibili [Scrivi commento] |
 © Apitalia - Tutti i diritti riservati © Apitalia - Tutti i diritti riservatiScritto in data 13/01/2016 da K. Crailsheim |
| COMMENTI A QUESTO ARTICOLO: 0 tot. |
|
|
| [Torna ad inizio pagina] |