Un'esclusiva per i lettori di Apitalia Online
[Condizioni di accesso ai contenuti di Apitalia Online]
| [Indice degli speciali online] |
| Scrivi il tuo commento a questo articolo! |
| 0 commenti disponibili [Scrivi commento] |
| Malattie | ||||||||||||||
| Il virus DWV: la chiave che apre le porte alla Varroa | ||||||||||||||
| di Francesco Nazzi*, Sam P. Brown**, Desiderato Annoscia*, Fabio Del Piccolo*, Gennaro Di Prisco***, Paola Varricchio***, Giorgio Della Vedova*, Federica Cattonaro****, Emilio Caprio***, Francesco Pennacchio*** | ||||||||||||||
| Qualsiasi fattore che indebolisce il sistema immunitario dell’ape, determinerà un graduale incremento nel punto di stabilità, sino ad arrivare a una situazione critica che rischierà di sfociare nella replicazione virale incontrollata. Ringraziamo Savorelli per il riadattamento del lavoro e PLoS Pathog per l’autorizzazione alla pubblicazione | ||||||||||||||
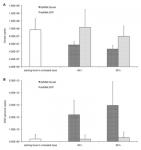
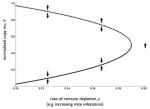
 Introduzione IntroduzioneNegli ultimi anni sono state osservate consistenti morie di alveari in tutto il mondo. Una sindrome denominata Colony Collapse Disorder (CCD), riportata negli USA dal 2006, ha attratto l’attenzione della comunità scientifica e dell’opinione pubblica. Tuttavia, elevate perdite invernali, non relazionate a CCD,sono state riportate in molte parti del mondo e anche in USA. CCD sembra non essere la sola causa di mortalità di alveari.Relativamente al CCD vi è ora un generale consenso sul fatto che molti fattori siano coinvolti nella sindrome. Recenti studi suggeriscono che il collasso degli alveari sia dovuto all’interazione tra patogeni e altri fattori di stress inclusa Varroa destructor Anderson & Trueman che può trasmettere virus patogenici, spesso associati al collasso dell’alveare e determinare una sindrome di immunodepressione nell’ape ospite, non ancora pienamente compresa a livello molecolare. Relativamente noto il ruolo della Varroa, e dimostrato il suo ruolo di vettore di virus. I dettagli funzionali di questa pericolosa associazione rimangono ancora poco definiti. In particolare, l’associazione con il virus delle ali deformate Deformed Wing Virus (DWV) appare particolarmente interessante in conseguenza dell’aumento della quantità di prove scientifiche sul ruolo dei virus nelle mortalità di alveari. DWV può essere trasmesso verticalmente dalla regina alla discendenza, causando infezioni coperte (non sintomatiche ndt). Le conoscenze scientifiche suggeriscono che la quantità di DWV presente possa essere amplificata dalla concomitante infestazione da V. destructor, arrivando a produrre infezioni aperte e dannose. Nonostante significativi contributi scientifici, il meccanismo di questa interazione rimane non chiaro. Il presente studio ha cercato di colmare il gap, verificando a livello di popolazione di api e a livello molecolare i maggiori cambiamenti che avvengono, portando la famiglia al collasso,in associazione a infestazione da V. destructor. Per fare ciò si è utilizzato un approccio basato sulla comparazione di colonie esposte a differenti livelli di presenza di V. destructor, ma mantenute nello stesso ambiente (identica disponibilità alimentare ecc, ndt). Risultati Dinamica di popolazione di api In una località isolata sono stati collocati i due apiari sperimentali, uno dei quali ha ricevuto i trattamenti varroacidi convenzionali (che chiameremo famiglie poco infestate FPI); l’altro è stato lasciato senza trattamenti per monitorare gli effetti dell’aumento della popolazione di acari (Famiglie non trattate, molto infestate NTMI). Un certo declino nella popolazione di api è stato osservato in tutte le famiglie nel corso dell’estate.Una marcata accelerazione del declino è stata notata nelle famiglie NTMI, avanti nella stagione, così da osservare, a fine ottobre, una significativa riduzione della popolazione di api (Figura 1A). Parassiti e Patogeni L’analisi metagenomica dei campioni di api raccolti in ottobre ha rivelato la presenza di pochi simbionti comuni (Tabella S1). Relativamente ai patogeni non virali, Nosema ceranae, è risultato presente a livelli similari (Tabella S1) nei due apiari. La ricerca di virus, ha mostrato la presenza di Black Queen Cell Virus (BQCV), Deformed Wing Virus (DWV) e Sacbrood Virus (SBV). La quantità di presenza di BQCV e SBV risulta fluttuare durante la stagione, ma soprattutto i due virus tendono a scomparire (Figura S1). Per contro, la presenza di DWV aumenta nel corso della stagione e in Settembre si avvicina il 100% di presenza (in pratica in tutte le api vi è un certo livello di presenza virale, ndt) in tutti i gruppi di studio (Figura 2B), come riscontrato già in altri studi. In Ottobre, la presenza virale sulle api non trattate, NTMI, risulta molto più alta (Figura 2C) e il significativo aumento di mortalità osservato (Figura 1B) è associato con l’alto carico virale che supera 10.000.000.000.000.000 virus per ape (nel gruppo FPI vi è minor presenza virale e le api muoiono di meno, ndt). L’aumento di carico virale (associato a intensa infestazione da Varroa) e il suo impatto letale sono stati confermati anche da verifiche di laboratorio. Un significativo aumento della quantità di DWV, in larve artificialmente infestate, risulta scatenato dal comportamento di nutrizione di Varroa (Figura 3A). In aggiunta, il livello di infezione virale influenza marcatamente la sopravvivenza delle api. Infatti, l’iniezione di differenti diluizioni di lisato di ape ottenuto da api con deformazioni alle ali dà luogo a mortalità di api significativamente superiori a quella del controllo per basse e alte concentrazioni, rispettivamente e positivamente correlate alla concentrazione di lisato iniettata (Figura 3B). L’effetto può essere considerato il risultato di differenti livelli di DWV iniettato. Infatti, il virus era esclusivamente presente nel lisato di api sintomatiche e assente negli estratti di controllo. Sistema immunitario delle api Per far luce sulle alterazioni del sistema immunitario dell’ape associate alla replicazione virale indotta da Varroa si sono usate tecniche di biologia molecolare. Un effetto di immunodepressione è risultato evidente nelle api poco infestate, caratterizzato da sotto regolazione (produzione di elementi proteici inferiore alla norma, ndt) di 19 geni immunitari. L’effetto più pronunciato è osservato sulle molecole di segnalazione dorsal-1A, membri della famiglia di proteine NF-κB, e serina proteasi; un relativamente più basso, grado di sotto regolazione è stato osservato per quelle di ricognizione (AmSCR, scavenger receptors B5 e B7, C-type lectin 8) e per alcuni componenti del sistema di segnalazione immunitario (Tabella 1, Tabella S2) (per dirla in parole molto semplici, la varroa rompe la centralina di controllo del sistema di allarme, ndt). La sindrome immunodepressiva è associata a significativo aumento di regolazione di 6 geni immunitari codificanti molecole per ricognizione (PGRP-S2, NimC2, Eater-like) e segnalazione (serina proteasi) (Tabella 1, Tabella S2), parte delle quali ha un ruolo nella fagocitosi. Si è potuto dimostrare che sono i virus DWV ad avere un ruolo importante nella sotto regolazione del gene dorsal-1A, e ciò può essere considerato come facente parte della strategia di virulenza adottata da DWV per aggirare uno dei componenti centrali della immunità antivirale degli insetti. Per corroborare questa ipotesi, si è verificato se l’abbondanza di trascrizione di dorsal-1A può condizionare l’infezione virale nelle api. I risultati dimostrano che una riduzione di disponibilità di NF-κB ( la famiglia da cui deriva dorsal-1A, ndt) promuove la replicazione virale. Significa anche che ogni fattore di stress che necessita risposte mediate da NF-κB può portare ad una “competizione per l’uso” dei fattori di contenimento del virus: che può significare aumento della replicazione virale. Dinamica delle Interazioni Multiple Per esplorare la dinamica dell’interazione Varroa-DWV si sono costruiti e analizzata una serie di modelli basati su un certo numero di virus fronteggiati da una risposta immunitaria che può essere variata dalla presenza del virus stesso e da altri elementi di stress. In un modello di riferimento, caratterizzato da infezione cronica con livello di immuno eccitazione costante (risposta immunitaria costante, ndt), si è visto che la presenza virale rimane a un livello intermedio e stabile. Se al contrario si ha costante immunodeficienza, compare una dinamica virale aggressiva, con tutte le infezioni, partenti da diversi livelli iniziali, che prevalgono sulle difese dell’ape e raggiungono una crescita esplosiva. Semplici modelli possono essere costruiti a partire dalla quantità di virus che si vuole considerare (bassa, alta, aperta infezione) mettendola in relazione con la risposta immunitaria. In assenza di altri sforzi immunitari da parte dell’ape (Figura 6), DWV può essere mantenuto a un basso livello di presenza fino a quando DWV è mantenuto sotto una soglia critica. Qualsiasi fattore che indebolisca il sistema immunitario causerà un graduale aumento nel punto di stabilità, fino ad arrivare ad una situazione critica che sfocia nella replicazione virale incontrollata. Ovvero, gli aumenti di presenza virale, in seguito a piccole replicazioni sfuggite al controllo, potranno essere “imbrigliati” dal sistema immunitario, ma lasciando ogni volta una più elevata quantità di virus “nelle carceri”, potenzialmente minacciosa. A furia di indebolimenti del sistema immunitario si arriva alla replicazione esplosiva. Discussione Il decorso dell’infestazione da Varroa non rispecchia esattamente l’aumento di mortalità di api, parallelamente riscontrabile, suggerendo che altri fattori di mortalità siano presenti e interagiscano con la Varroa. I dati di campo sono anche in questo caso corroborati dagli esperimenti di laboratorio che mostrano come il comportamento di nutrizione della varroa scateni la replicazione virale nell’ape , la quale mostra un tasso di mortalità positivamente correlato al carico virale presente. L’effetto negativo dell’associazione tra acaro Varroa e virus DWV è stato ampiamente investigato e molti dettagli di questa pericolosa interazione sono stati rivelati. Il presente studio dimostra i dettagli meccanicistici dell’associazione virus-acaro, provando a gettare luce sul collegamento funzionale tra livello di infestazione da V. destructor, abbondanza di DWV e mortalità di api. E’ evidenziata una severa alterazione, con espressione inferiore alla norma, del profilo di trascrizione di alcuni geni immunitari. In particolare, la carenza di espressione (produzione) di NF-κB indica che l’interazione patogeno-parassita può interferire con una quantità di risposte immunitarie regolate da questi fattori. Ne deriva una diminuzione delle difese immunitarie del tipo sintesi di proteine (peptidi) anitimicrobici, coagulazione, melanizzazione e difese antivirali. L’effetto immunodepressivo sembra in larga misura prodotto dalla replicazione virale, dal momento che si è osservato che la sola nutrizione da parte della varroa non pare influenzare i livelli di espressione di dorsal-1A, il gene maggiormente sotto espresso “in condizione patologica” che abbiamo utilizzato come indicatore di immuno deficienza. Nell’insieme, queste prove sperimentali indicano che DWV può utilizzare una strategia di guerra (virulenza) che distrugge le segnalazioni a funzionalità immunitarie NF-κB. Il significativo aumento di quantità di virus (copie di genoma) DWV, conseguente all’annientamento del “sistema” dorsal-1A prodotto a scopo sperimentale con RNAi, mostra che il gene svolge un ruolo cruciale nella risposta immunitaria che controlla la replicazione di DWV e corrobora l’ipotesi che DWV adotti una strategia di guerra in parte basata sulla “eliminazione fisica” dei membri della famiglia di nome NF-κB. Ciò suggerisce che qualsiasi risposta immunitaria antivirale, relazionata a questa famiglia (fattore di trascrizione), è ridotta ma non fortemente soppressa, come accade con virus più aggressivi. Perciò, il delicato equilibro che mantiene a livello inapparente (coperta) una infezione DWV può essere alterato da qualsiasi fattore di stress che necessita la risoluzione del problema da parte della famiglia NF-κB. In altre parole, una limitata disponibilità di questo fattore di trascrizione (come un limitato numero di carabinieri nella caserma di una città piena di malfattori, ndt) sembra essere sufficiente a mantenere sotto controllo l’infezione da DWV, la quale, tuttavia, può esprimere intense moltiplicazioni nei casi in cui NF-κB viene sostanzialmente è da esigenze immunitarie di altro tipo (mandare i carabinieri in missione altrove, ndt). Negli insetti le ferite all’esoscheletro attivano la coagulazione e la melanizzazione che sono dipendenti da NF-κB; perciò la reazione dell’ape alle ferite prodotte dalla varroa, allo scopo di nutrirsi, sottrae le difese necessarie al controllo del DWV nelle api infette e, di conseguenza, promuove una intensa replicazione virale che può, per giunta, essere aggravata dalla iniezione di addizionali virus “alloggiati” nella varroa (la situazione può perciò essere migliore se l’ape non è infetta da DWV, ndt) . La immunodeficienza provocata dal DWV, con l’«uccisione» della famiglia NF-κB, “fa gioco” alla varroa poiché rinforza la distruzione delle difese immunitarie attivate dalla ferita prodotta a scopo di nutrizione e dai componenti della saliva della varroa. Si consideri che dalla stessa ferita si alimentano la varroa madre e le figlie e che la coagulazione e la melanizzazione possono ostacolare parecchio l’attività di nutrizione. Possiamo, perciò, ragionevolmente supporre che l’associazione Varroa-DWV possa essere interpretata come una simbiosi mutualistica (una società di mutuo soccorso, ndt). |
||||||||||||||
| IMMAGINI ALLEGATE A QUESTO ARTICOLO: 7 tot. | ||||||||||||||
|
||||||||||||||
| Scrivi il tuo commento a questo articolo! |
| 0 commenti disponibili [Scrivi commento] |
 © Apitalia - Tutti i diritti riservati © Apitalia - Tutti i diritti riservatiScritto in data 24/01/2013 da Francesco Nazzi*, Sam P. Brown**, Desiderato Annoscia*, Fabio Del Piccolo*, Gennaro Di Prisco***, Paola Varricchio***, Giorgio Della Vedova*, Federica Cattonaro****, Emilio Caprio***, Francesco Pennacchio*** *Dipartimento di Scienze Agrarie e Ambientali, Università degli Studi di Udine, Udine, Italy, **Centre for Immunity, Infection and Evolution, School of Biological Sciences, University of Edinburgh, Edinburgh, United Kingdom, ***Dipartimento di Entomologia e Zoologia Agraria “Filippo Silvestri”, Università degli Studi di Napoli “Federico II”, Portici (Napoli), Italy, ****Istituto di Genomica Applicata, Parco Scientifico e Tecnologico Luigi Danieli, Udine, Italy |
| COMMENTI A QUESTO ARTICOLO: 0 tot. |
|
|
| [Torna ad inizio pagina] |